Die Gynäkopathologie in Deutschland wurzelte über ca. 1 Jahrhundert in den Universitätsfrauenkliniken (siehe u.a. 100 Jahre Universitätskrankenhaus Eppendorf: ATTEMPTO 1989). Deren Protagonisten waren von Anfang an Verfechter einer interdisziplinären Forschung und Praxis. Konsequent griffen sie neue wissenschaftliche Erkenntnisse der molekularpathologischen Forschung auf, die auf einen Paradigmenwechsel tradierter Konzepte hindeuteten (Stegner 1994, Löning und Riethdorf 2001). Dieser Paradigmenwechsel betraf schließlich auch die Tumorklassifikationen. Stand vor einigen Jahrzehnten noch die Korrelation der Histomorphologie mit dem klinischen Bild bzw. dem Verlauf einer Tumorerkrankung als wesentliche Grundlage für Einteilungssysteme zur Verfügung, kommt es heutzutage zunehmend zu einer Ergänzung durch genetische Veränderungen der Tumoren. Die Integration molekularpathologischer Erkenntnisse in die Betrachtung von Tumoren und deren Vorstufen hat einerseits zu einer Vereinfachung der Einteilung geführt, andererseits auch zu einer Schaffung neuer bzw. Reaktivierung zuletzt verlassener Entitäten.
Mit der 2014 erschienenen, novellierten Ausgabe der WHO-Klassifikation von Tumoren des weiblichen Reproduktionstraktes wurde die dreistufige Einteilung plattenepithelialer intraepithelialer Neoplasien der Cervix uteri (CIN 1-3) zugunsten einer zweistufigen Einteilung in low-grade- und high-grade-Läsionen verlassen, wobei allerdings ausdrücklich auf die Option einer Eingruppierung nach dreistufiger CIN-Terminologie (in Parenthese oder Kommentar) hingewiesen wird. Die letztgenannte Entscheidung nimmt ganz speziell die Einwände klinischer Experten auf, denen zufolge ansonsten die Vergleichbarkeit von Studien (z.B. Vakzinationsstudien) gefährdet, und die „wait and see“ Strategie bei besonders jüngeren Frauen mit CIN 2 kompromittiert wird. Die Einteilung der dysplastischen Epithelver¬änderungen erfolgt dabei in Anlehnung an das in der gynäkologischen Zytologie - im englischen Sprachraum - etablierte Bethesda-System. Entsprechend werden unter den "low-grade squamous intra-epithelial lesions" (LGSILs) Kondylome und geringe Dysplasien (bislang CIN 1) zusammengefasst. Unter "high-grade squamous intraepithelial lesions" (HGSILs) werden die mäßige und schwere Dysplasie (bislang CIN 2 und CIN 3) subsumiert. Der Anspruch der neuen Klassifikation ist es, 1.) die „klassische“ Dysplasiegradierung (anhand struktureller und zellulärer Atypien) um die pathogenetisch bzw. zellbiologisch relevanten Charakteristika der HPV-Assoziation zu erweitern, und damit 2.) die unterschiedliche Tendenz zur Progression dieser Läsionen in Abhängigkeit einer "high-risk"- oder "low-risk"-HPV-Infektion zu berücksichtigen. Wichtiges Hilfsmittel zur Unterscheidung (post-) inflammatorischer und meta- sowie hyperplastischer Läsionen von echten Präkanzerosen ist der Einsatz von p16 als Surrogatmarker der high-risk-HPV-Infektion (bevorzugt in Kombination mit KI67/MIB1-Immunhistochemie zu nutzen). Damit gelingt auch die Sicherung der meisten glandulären Präkanzerosen der Cervix uteri (Adenocarcinoma in situ = AIS/ ACIS sive "high-grade" zervikale glanduläre intraepitheliale Neoplasie = HG-CGIN). Die im Falle nur gering ausgeprägter zellulärer glandulärer Atypien bislang gebräuchlichen Einordnungen als endozervicale glanduläre Dysplasien (EGD) oder als "low-grade" glanduläre zervikale intraepitheliale Neoplasie (LG-CGIN) wird der aktualisierten WHO-Klassifikation zufolge hinfällig. Subgruppen der glandulären Präkanzerosen der Cervix uteri können analog zu den Subgruppen der zervikalen Adenokarzinome unterschieden werden. Klinisch-pathologisch ist jedoch lediglich von Bedeutung, daß im Unterschied zu den plattenepithelialen (Prä-) Neoplasien bis zu 25% (in Japan!) der glandulären Präkanzerosen und Karzinome HPV-negativ sind. In diesen Situationen ist eine Diagnosesicherung oft nur durch hohe Konisation möglich.
Auch die Klassifikation der Präneoplasien und Neoplasien des Endometriums wurde vereinfacht. So sind nur noch zwei (statt vorher vier) Gruppen der Endometriumhyperplasie zu berücksichtigen: die Endometriumhyperplasie ohne Atypien und die Endometriumhyperplasie mit Atypien. Alternativ und synonym kann der Begriff der endometrialen intraepithelialen Neoplasie (EIN) verwendet werden. Die mit der malignen Transformation assoziierten molekularen Veränderungen in Form des Verlustes der Expression von PTEN bzw. PAX-2 werden nicht als Voraussetzung für die Diagnose einer atypischen Endometriumhyperplasie erachtet.
Ebenso wurde die Klassifikation des Endometriumkarzinoms vereinfacht, wobei die duale Betrachtungsweise in Form der biologischen Typen I und II bekräftigt und durch molekulare Ergebnisse untermauert wurde. Die histologischen Varianten des endometrioiden Karzinoms sind gegenüber dem Differenzierungsgrad zu vernachlässigen. Gemischte Karzinome müssen per definitionem aus einer Typ I- und einer Typ II-Komponente bestehen (zum Beispiel endometrioid-seröse oder endometrioid-klarzellige Mischform), nicht jedoch aus einer Mischung unterschiedlicher histologischer Varianten des endometrioiden Karzinoms. Als eine spezielle Form des undifferenzierten Karzinoms wurde das dedifferenzierte Karzinom aufgenommen. Dabei handelt es sich um Neoplasien mit einem gut differenzierten und einem völlig undifferenzierten Tumoranteil, wobei der undifferenzierte prognostisch relevant ist. Die letztgenannte Tumorerkrankung soll gehäuft mit dem HNPCC/Lynch-Syndrom assoziert sein.
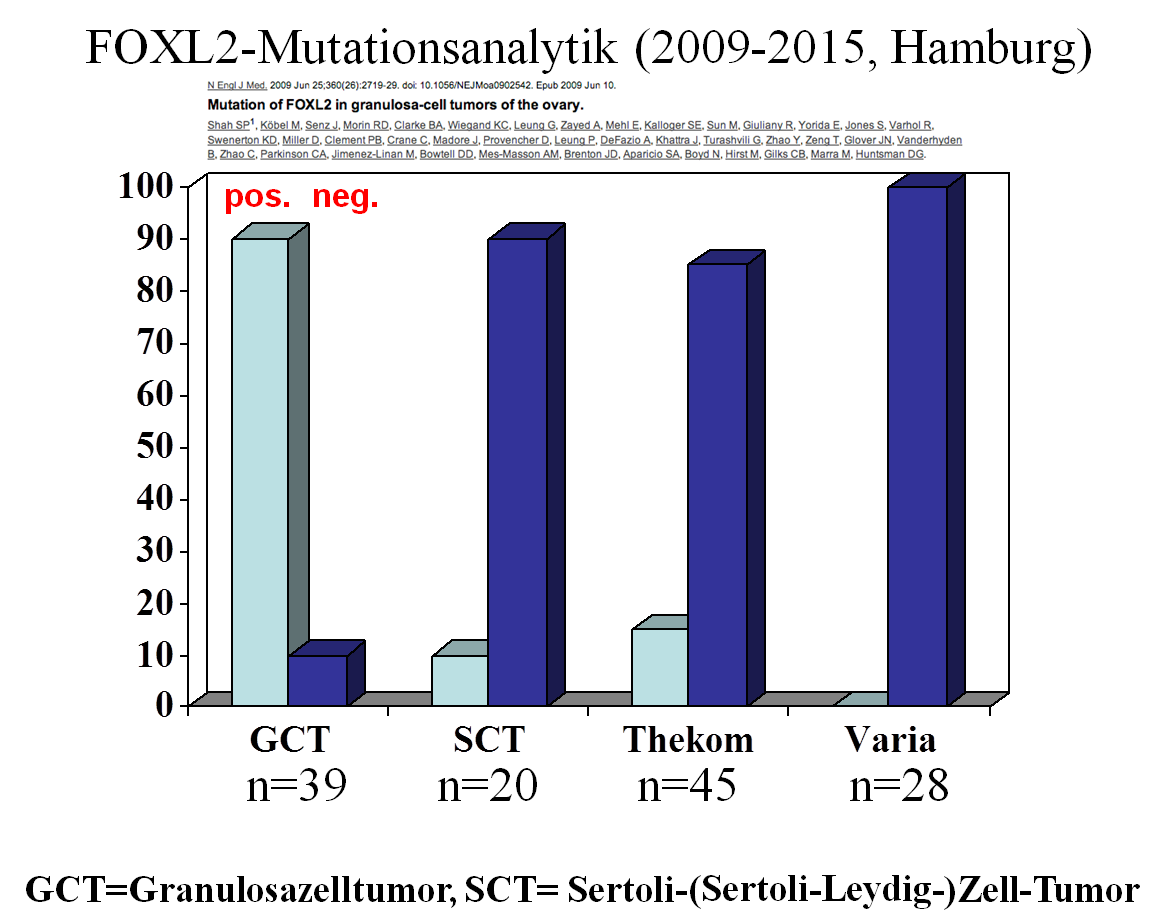
Ebenso wie bei den Endometriumkarzinomen wird bei den Ovarialkarzinomen der Versuch unternommen, molekulare Prinzipien der Klassifikation einzuführen. Dies gelingt speziell für die serösen Neoplasien des Fimbrientrichters und Ovars, während sich für die zahlenmäßig nachgeordneten Tumortypen des Epithels (muzinös, endometrioid, klarzellig etc.), Keimstrangstromas und der Keimzellen kaum Änderungen ergeben haben. Dies trifft mit wenigen Ausnahmen (z.B. neue STUMP-Definitionen, besonderer Geno- und Phänotyp eines endometrialen high grade Sarkoms) auch auf die mesenchymalen Tumorerkrankungen zu.
Tabelle 2. Gyn-Tumore mit klinikrelevanten Kandidaten- und Fusionsgenen.
| Tumorentität | Translokation / aberrante Region |
Fusions- / Kandidatengene |
|---|---|---|
| Mamma-BRCA Mamma-sekret.Karzinom |
varia t(12; 15) (t13; q25) |
varia ETV6-NTRK3 |
| Zervixdrüsenkarzinom Endometriumkarzinom |
PJS, 19p MSI-varia |
STK11/LKB1 varia |
| Leiomyom | t(12;14) (q15;q23-24) Xq13.1 |
HMGA2 mut. MED12 |
| Stromaknoten/LGESS HGESS |
t (7; 17) (p21;q15) t (10;17) (q22;p13) |
JAZF1-SUZ12 YWHAE -FAM22 |
|
|
|
|
| seröses Adnexkarzinom HG | 17p13.1 | mut. TP53 |
| Granulosazelltumor | 3q23 | mut. FOXL2 |